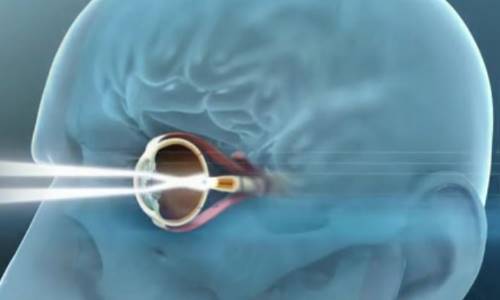
Un implant rétinien pour mieux se repérer dans l'espace ? Si le dispositif est toujours en phase d'expérimentation -il est testé depuis 2013 sur l'Homme- il fait progressivement son chemin. En France, l'implant IRIS II, fabriqué par la société Pixium Vision, a été posé pour la troisième fois. Au CHU de Nîmes, c'est un patient de 40 ans, devenu non-voyant des suites d'une rétinite pigmentaire, qui a été opéré le 14 octobre 2016.
Pour une plus grande autonomie
L'intervention fait partie d'un essai clinique européen organisé par Pixium Vision. Ce projet, baptisé « Compensation de la cécité à l'aide du système d'implant rétinien intelligent », concerne des patients atteints de dystrophie rétinienne. Son principe ? « Restaurer un minimum de vision pour faire passer des patients du statut d'aveugle à celui de malvoyant, et pour leur redonner un minimum d'autonomie », explique Dr Gérard Dupeyron, chef du service ophtalmologie du CHU de Nîmes, qui a supervisé l'opération.
Plus d'une centaine d'électrodes
Le dispositif condense trois technologies : un implant positionné sur la rétine, un transmetteur sans fil ainsi qu'une paire de lunettes, équipée d'une mini-caméra, qui fonctionne comme une rétine humaine en captant les événements de l'environnement et en générant les données visuelles. L'implant, lui, porte les électrodes -150 au total !- qui vont recevoir les informations visuelles du transmetteur et envoyer les signaux électriques de stimulation vers le nerf optique. Il est alimenté par induction avec des bobines intégrées dans les lunettes ; le signal vidéo est transmis par signal haute fréquence. À noter que l'implant est interchangeable, ce qui permet aux patients de bénéficier d'un remplacement ou d'une version améliorée dans le futur.
Une cécité de moins de 5 ans
« Il ne s'applique pas à toutes les personnes aveugles mais aux patients devenus non-voyants des suites d'une rétinite pigmentaire », souligne le chirurgien. Cette maladie dégénérative touche 60 000 personnes en France. Elle se caractérise par une perte progressive et graduelle de la vision, qui conduit généralement à la cécité. Les personnes sélectionnées pour la pose d'implant rétinien doivent également répondre à des critères médicaux et psychologiques précis. « L'implant doit être posé sur des patients aveugles depuis moins de 5 ans, qui ont conservé une bonne « connexion » entre la rétine et le cerveau », précise Dr Dupeyron. Les personnes aveugles de naissance ne peuvent donc pas être opérées pour le moment.
Un recrutement très sérieux
La sélection des patients est effectuée au centre de référence des maladies génétiques ophtalmologiques du CHU de Montpellier, et encadrée par Dr Christian Hamel. Sur le plan médical, l'opération implique d'avoir un œil en bon état et de ne présenter aucune autre maladie oculaire. Des examens sont effectués pour vérifier que l'espace entre l'œil et la paroi de l'orbite est suffisant pour y insérer le récepteur. Par ailleurs, d'un point de vue psychologique, les patients doivent « présenter un certain enthousiasme sans investir trop d'espoir dans l'intervention ». « C'est un juste équilibre à trouver chez le patient. Il doit pouvoir être motivé tout en restant réaliste », explique le chef de service.
De potentiels risques
L'intervention, qui dure trois heures, s'apparente à un traitement du décollement de la rétine. Pour pouvoir placer le récepteur sur la rétine, le chirurgien doit effectuer une incision du globe oculaire. « Ce qui est important, c'est de garder la paroi du globe étanche. Mais c'est quelque chose que l'on maîtrise bien aujourd'hui », précise Dr Didier Audemard, chirurgien qui a effectué l'opération. Par ailleurs, comme pour toute pose de prothèse importante, un risque d'infection est à prendre en compte.
Plus de six mois de rééducation
À la suite de l'opération, une période de rééducation en trois temps est indispensable. Et, justement, c'est en partie pour son centre de rééducation pilote, l'institut ARAMAV, spécialisé en basse vision et en réadaptation oculaire, que le CHU de Nîmes a été sélectionné pour effectuer l'implantation. Dans un premier temps, les patients sont gardés un mois pour régler la caméra et l'intensité des signaux électriques. Chaque électrode doit être testée 40 fois. « Nous passons ensuite en phase d'appropriation afin que le patient apprenne à s'adapter à ces flashs, qui ne sont pas naturels », explique le Dr Luc Jeanjean, responsable de l'unité de neuro-ophtalmologie du CHU de Nîmes.
Que voit le patient ?
La véritable rééducation débute, elle, au bout de six mois. Le patient doit savoir utiliser sa vision, qui s'effectue par points lumineux, afin de se repérer plus facilement et d'analyser son environnement. Pas question pour autant de distinguer des couleurs ou des formes précises. « Nous sommes toujours au début des travaux, explique Dr Dupeyron, qui compare la recherche en vision prothétique à la conquête de l'espace. Durant la prochaine étape, si nous améliorons la dissémination des implants, des formes pourraient être interprétées. »
Des recherches porteuses d'espoir
« Cette pose conforte nos espoirs d'améliorer notablement la vie de personnes devenues malvoyantes, confie Vincent Michel, président de la Fédération des aveugles de France. C'est un signe fort qui nous invite à poursuivre nos efforts et notre soutien en faveur de la recherche en ophtalmologie ». Dr Dupeyron précise, de son côté, que ces recherches sont surtout possibles grâce à un bon fonctionnement du cerveau : « Nous lui donnons des sensations qu'il peut utiliser. Même si nous implantons l'œil, c'est le cerveau que nous rééduquons ». Prochaine opération le 20 décembre 2016.
© Pixum Vision