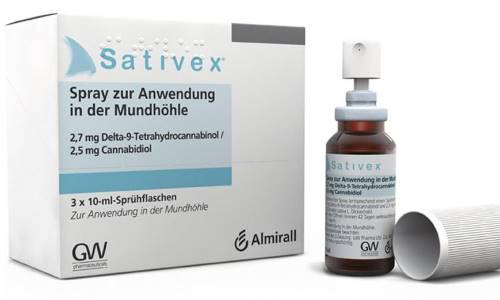
Le Sativex, spray buccal destiné à soulager les problèmes de spasticité (augmentation de la tension musculaire) des personnes atteintes de sclérose en plaques, aurait dû rejoindre les rayons des pharmacies françaises fin 2014 (lire article en lien ci-dessous). Médicament thérapeutique composé d'extraits de cannabis, il n'est toujours pas mis en vente en France alors qu'en Europe, 18 pays l'ont commercialisé. À l'origine du blocage, des négociations de prix stagnent entre la firme Almirall, laboratoire qui produit le Sativex, et le CEPS (Comité économique des produits de santé), organisme interministériel qui fixe les prix des médicaments et les tarifs des dispositifs médicaux pris en charge par l'assurance maladie obligatoire.
Un dialogue de sourds de plusieurs mois
En France, le processus de commercialisation d'un médicament se fait via trois instances : la Haute autorité de la santé (HAS), via une commission de transparence, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), qui octroie la mise en vente, et le CEPS qui détermine le prix. Les négociations s'établissent par convention. « Nous avons obtenu l'autorisation de mise en vente en janvier 2014, annoncée en grande pompe à l'époque par la ministre de la Santé Marisol Touraine », explique Christophe Vandeputte, directeur général d'Almirall en France. La seule étape qui bloque la mise sur le marché du Sativex est un désaccord sans fin sur le prix entre le CEPS et le laboratoire. Initialement, Almirall France proposait de vendre le Sativex 350 euros la boîte, soit 20% de moins que le prix moyen fixé en Europe (440 euros). Prix que le laboratoire a légèrement revu à la baisse, en descendant à 320 euros. Le CEPS, de son côté, ne lui en offre pas plus de 90 euros.
Silence radio au ministère
En mai 2016, M. Vandeputte a adressé une lettre de mise en demeure au Comité, qui a répondu par un refus le mois suivant. Le laboratoire a renvoyé une nouvelle proposition en juillet 2016 mais le CEPS n'a pas réagi depuis. « J'ai renvoyé une deuxième mise en demeure en septembre 2016, confie M. Vandeputte. Nous n'avons toujours pas de réponse mais réclamons toujours une position claire. » Sans le feu vert du Comité, la commercialisation du traitement reste donc bloquée. Le CEPS, sollicité par la rédaction, ne répond pas aux questions de Handicap.fr pour le moment.
« Trop peu de patients concernés »
Parmi la population française, on compte plus de 100 000 personnes atteintes de sclérose en plaques. Cette maladie auto-immune touche essentiellement la moelle épinière et le cerveau. Au total, 10 000 personnes seraient « éligibles » au Sativex et au moins 5 000 devraient y avoir recours, selon M. Vandeputte. Pour Jean-Michel Laville, de l'association Ensemble contre la sclérose en plaques, c'est « trop peu de malades pour que le ministère de la Santé s'y intéresse ». « Nous avons signé des pétitions et écrit au ministère en proposant une réunion avec le laboratoire ; certains patients ont entamé des grèves de la faim, en vain », raconte-t-il.
En cas de spasticité modérée et sévère
Parmi les patients atteints de sclérose en plaques, 80 à 90% développent une spasticité, sous des formes différentes : légère, modérée et sévère. « Le Sativex ne doit être prescrit qu'à ceux qui développent une spasticité modérée et sévère, et seulement au cas où le premier traitement prévu échoue », précise le directeur. Son efficacité est estimée comme faible par la HAS mais le Sativex pourrait tout de même soulager et rendre un minimum d'autonomie aux personnes les plus touchées. Composé de tétrahydrocannabinol (THC) et de cannabidiol (CDB), principes actifs du cannabis, il n'en n'a pas les effets euphorisants.
© Wikipédia